ASİT VE BAZLARIN ÖZELLİKLERİ
Bu yazımızda asitler ve bazların özelliklerine değineceğiz. Latince acidus kelimesi acere fiilinden türemiştir acere “ekşi olmak, keskin olmak, yakıcı olmak” anlamlarına gelir acidus ise “ekşi, asidik, keskin tatta olan” anlamına gelir bu şekilde kimyaya geçmiştir.
Asitler ve bazların en iyi tanımını İsveçli bilim adamı Svante August Arrhenius yapmıştır. 1887 yılında geliştirdiği kendi adıyla anılan Elektrolit Dissosaiya Teorisi’nde asit ve bazları tanımlamıştır. Yapısında (H+) ve (OH-) bulundurmayan maddelerin asitlik ve bazlıklarını açıklamada yetersiz kaldığı için daha sonraki yıllarda Bronsted-Lowry Asit Baz Tanımı ve Lewis Asit Baz Tanımları oluşturulmuştur. Arrhenius’a göre Suda çözündüğünde suya (H3O+) yani hidronyum veren maddeleri asit, (OH-) hidroksil iyonu verenleri ise baz olarak tanımlamıştır. Arrhenius’a göre H+ iyonunda elektron yoktur. Tamamen pozitif yükten oluştuğu için sulu çözeltilerde H2O molekülü ile birleşerek (H3O+) iyonunu hidronyumu oluşturur.
Bir maddeye asit veya baz diyebilmek için Suda iyonik çözünmesi ilk şarttır. Suda moleküler çözünen maddeler asit veya baz olamazlar.
Asitlerin Özellikleri
-
Suda çözününde ortama (H+) iyonu verir.
-
Ph ları 7’den küçüktür.
-
POH’ları 7’den büyüktür.
-
Sulu çözeltilerinde (H+) derişimleri (OH-) derişimlerinden fazladır.
-
Asitler mavi turnusolü kırmızıya, çevirir.
-
Tatları ekşidir.
-
Yakıcıdırlar, açık yara ve ele yakıcılık hissi verirler.
-
Aşındırıcı ve tahriş edicidirler.
-
Asitler ile bazlar vererek nötralleşme tepkimesi verirler, tuz ve H2O oluştururlar.
-
Suda çözününce iyonlaşma yüzdesi kuvvetliliğini belirler. %100 iyonlaşan asit kuvvetlidir.
-
Sulu çözeltileri elektrolit (elektriği ileten) maddelerdir elektrik akımını iletir.
-
Elektrik iletme miktarları derişimlerine ve kuvvetliliklerine bağlıdır. Kuvvetli olanlar daha iyi iletir.
-
Asitler Karbonat içeren tuzlar ile tepkimeye girebilirler. Bunun sonucunda tuz ve su birlikte (CO₂) gazı oluşur.
BAZLARIN ÖZELLİKLERİ
-
Suda çözününce ortama (OH-) iyonu verirler.
-
NaOH (suda) → Na⁺ (suda) + OH⁻ (suda)
-
PH’ları 7’den büyüktür.
-
POH’ları 7’den küçüktür.
-
Sulu çözeltilerinde (OH⁻) iyonu derişimleri (H+) derişimlerinden fazladır.
-
Bazlar kırmızı turnusol kağıdını maviye çevirir.
-
Tatları acıdır.
-
Kaygandırlar, ele kayganlık hissi verirler.
-
Aşındırıcı ve tahriş edicidirler.
-
Asitler ile bazlar vererek nötralleşme tepkimesi verirler, tuz ve H₂O oluştururlar.
-
Suda çözününce iyonlaşma yüzdesi kuvvetliliğini belirler. %100 iyonlaşan baz kuvvetlidir.
-
Sulu çözeltileri elektrolit (elektriği ileten) maddelerdir elektrik akımını iletir.
-
Elektriği iletme miktarları derişimlerine ve kuvvetlerine bağlıdır. Kuvvetli olanlar daya iyi iletir.
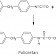
H içeren her bileşik asit değildir
C₆H₁₂O₆ (k) → C₆H₁₂O₆ (suda)
C₂H₅OH (s) → C₂H₅OH (suda)
OH içeren her bileşik baz değildir
Alkoller → R–OH … (örnek: C₂H₅OH, CH₃OH gibi)
Yapısında OH vardır ama baz değildir.
Yapısında OH⁻ içerse de suda çözündüğünde OH⁻ iyonu oluşturamadığından baz değildir.
İndikatörler
Bir maddenin asit mi baz mı, asit ve baz ise ne kadar kuvvetli ne kadar zayıf olduğunu anlamamıza yarayan maddelere indikatör denir.
|
İndikatör - Asit -Rengi - Baz Rengi |
|
Turnusol - Kırmızı - Mavi |
|
Timol Mavisi - Kırmızı - Sarı |
|
Bromofenol Mavisi - Sarı - Mavi |
|
Kongo Kırmızısı - Mavi - Kırmızı |
|
Metil Oranj - Kırmızı - Sarı |
Doğal İndikatörler
|
Doğal İndikatörler - Asit Rengi - Baz Rengi |
|
Kara Lahana - Pembe - Sarı |
|
Lavanta - Renksiz - Kahverengi |
|
Kuşburnu - Kırmızı - Koyu Yeşil |
|
Kiraz - Açık Pembe - Açık Sarı |
|
Kırmızı Soğan - Açık Kırmızı - Açık Kahverengi |
Günlük Hayatta Sıklıkla Kullandığımız Asitler ve Bazlar
Asetik Asit : Sirkenin ana bileşenidir (Sirke asidi). Gıdalarda tatlandırıcı ve koruyucu olarak kullanılır.
Sitrik Asit : Limon ve portakal gibi turunçgillerde doğal olarak bulunur. Gıdalarda ekşilik vermek ve koruyucu olarak kullanılır.
Sodyum Bikarbonat : "Karbonat" veya "Yemek Sodası" olarak bilinir. Kabartma tozu olarak, mide ekşimesine karşı ve temizlikte kullanılır.
Sodyum Hidroksit : "Sud Kostik" olarak bilinir. Sabun, deterjan ve lavabo açıcı gibi kuvvetli temizlik ürünlerinin yapımında kullanılır.
Amonyak : Keskin kokulu bir temizlik maddesidir. Özellikle cam temizleyicilerde ve yağ sökücülerde kullanılır.
Hidroklorik Asit : "Tuz Ruhu" olarak bilinir. Çok kuvvetli bir asittir ve tuvalet/banyo gibi zorlu yüzeylerin temizliğinde kullanılır. Aynı zamanda midemizde sindirimi sağlar.
Yazar:
Endüstriyel Tasarım Mühendisi