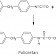
Kimyasal Tepkime (Reaksiyon) Nedir?
Kimyasal tepkime veya kimyasal reaksiyon, iki veya daha fazla maddenin atomik veya moleküler düzeyde birbiriyle etkileşime girerek özgün yapılarını kökten kaybetmesi, kimyasal bağlarının kırılması ve yeni fiziksel ve kimyasal özelliklere sahip maddelerin oluşması sürecidir.
Kimyasal Tepkime Sonucunda Neler Değişir?
Kimyasal tepkimeler, maddelerin atomik veya moleküler düzeyde yeniden düzenlenmesiyle yeni bileşiklerin veya elementlerin oluştuğu dönüşüm süreçleridir. Bu süreçte çeşitli fiziksel ve kimyasal değişiklikler meydana gelir:
-
Maddenin Özellikleri: Tepkimeye giren maddelerin kimyasal ve fiziksel özellikleri (renk, koku, erime noktası, çözünürlük, yanıcılık gibi) tamamen değişir ve yeni ürünlerin kendine özgü özellikleri ortaya çıkar.
-
Kimyasal Bağlar: Tepkime sırasında, atomlar arasındaki mevcut kimyasal bağlar kırılır ve farklı kombinasyonlarla yeni bağlar oluşur. Bu, maddeyi moleküler düzeyde tamamen farklı bir yapıya dönüştürür.
-
Enerji Değişimi: Kimyasal tepkimeler sırasında enerji açığa çıkabilir (eksotermik tepkimeler) veya enerji soğurulabilir (endotermik tepkimeler). Bu enerji değişimi genellikle ısı, ışık veya elektrik enerjisi şeklinde gözlemlenir.
-
Kütle ve Madde Dağılımı: Reaksiyona giren maddelerin kütlesi korunurken, atomlar farklı düzenlerde birleşerek yeni maddeleri oluşturur.
Kimyasal Tepkime Sonucu Oluşan Maddelere Ne Denir?
Bir kimyasal tepkime gerçekleştiğinde, başlangıçta reaksiyona giren maddeler dönüşüme uğrayarak yeni bileşikler veya elementler oluşturur. Tepkime sonucunda ortaya çıkan bu yeni maddelere ürün adı verilir. Ürünlerin kimyasal ve fiziksel özellikleri, tepkimeye giren maddelerden farklıdır.
Yeni Oluşan Maddeler Eski Özelliklerini Göstermezler
-
Kimyasal tepkime sırasında atomlar arasında elektron alışverişi veya ortaklaşması olur.
-
Bu durum atomların yeni bağlar kurmasına ve tamamen farklı bir molekül ya da bileşik oluşmasına neden olur.
-
Yeni oluşan bileşiğin iç yapısı, eski maddelerden farklı olduğu için fiziksel ve kimyasal özellikleri de farklı olur.
Elektron Dizilimi ve Kimyasal Özellikler
Elektron dizilimi kimyasal özellikleri belirler çünkü bir atomun tepkimeye girip girmeyeceğini, nasıl bağ yapacağını ve hangi tür maddelerle etkileşeceğini elektronları belirler.
Ekzotermik ve Endotermik Tepkimeler
Ekzotermik tepkime
Tepkime sırasında çevreye ısı veren kimyasal tepkimelerdir. Ortam ısınır.
- CH4 + 2O2 → CO2 + 2H2O + ısı
- 2H2 + O2 → 2H2O + ısı
- C + O2 → CO2 + ısı
- HCl + NaOH → NaCl + H2O + ısı
- 2Mg + O2 → 2MgO + ısı
Endotermik tepkime
Tepkimenin gerçekleşmesi için çevreden ısı alan kimyasal tepkimelerdir. Ortam soğur.
- 2H2O + ısı → 2H2 + O2
- CaCO3 + ısı → CaO + CO2
- 2KClO3 + ısı → 2KCl + 3O2
- NH4Cl + ısı → NH3 + HCl
- N2 + O2 + ısı → 2NO
Polimerleşme Tepkimeleri
Polimerleşme tepkimesi, küçük moleküllerin (monomerlerin) birbirine bağlanarak uzun zincirli büyük moleküller (polimerler) oluşturmasıdır. Günlük hayatta kullandığımız plastiklerin, naylonun, kauçuğun çoğu bu tepkimelerle elde edilir.
Genel gösterim:
-
n (monomer) → polimer
-
n CH2=CH2 → (–CH2–CH2–)n (Polietilen)
-
n CH2=CHCl → (–CH2–CHCl–)n (PVC)
-
n CF2=CF2 → (–CF2–CF2–)n (Teflon)
-
n CH2=CH–CH3 → (–CH2–CH(CH3)–)n (Polipropilen)
Hidroliz Tepkimeleri
Hidroliz tepkimesi, bir bileşiğin su ile tepkimeye girerek daha küçük moleküllere ayrılmasıdır.
Hidroliz Tepkimesi Özellikleri
-
Su kullanılır
-
Büyük molekül → küçük moleküller
-
Bağlar su yardımıyla kırılır
Protein + (n – 1) H2O → n (Aminoasit)
Karbonhidrat + (n – 1) H2O → n (Monosakkarit)
Yağ + H2O → Yağ Asidi + Gliserin
Sakkaroz + H2O → Glikoz + Fruktoz
Nişasta + n H2O → n Glikoz
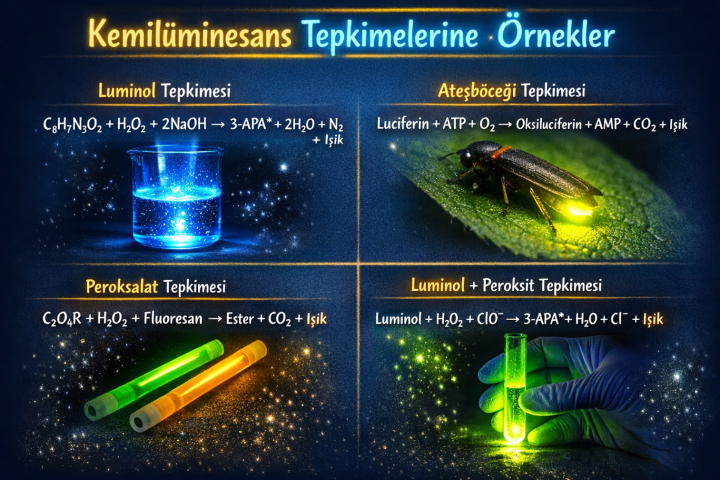
Kemilüminesans Tepkimesi Nedir?
Kemilüminesans, kimyasal bir tepkime sırasında ortamdan ışık yayılmasıdır. Bu olay, atomların elektronlarının enerji seviyelerinin değişmesiyle gerçekleşir. Hem dikkat çekici olması hem de bazı maddelerin tespit edilmesinde kullanılabilmesi nedeniyle yaygın olarak kullanılır.
Kimyasal Tepkime Türleri Nelerdir?
Kimyasal tepkimeler, maddenin atomik ve moleküler düzeyde yeniden düzenlenmesiyle yeni maddelerin oluşmasını sağlayan süreçlerdir. Bu tepkimeler, oluşum mekanizmalarına ve gerçekleşme şekillerine göre farklı kategorilere ayrılabilir. En yaygın kimyasal tepkime türleri şunlardır:
1. Sentez (Birleşme) Tepkimeleri
İki veya daha fazla basit maddenin birleşerek daha karmaşık bir bileşik oluşturduğu reaksiyonlardır.
Genel denklem: A + B → AB
Örnek: 2H₂ + O₂ → 2H₂O (Su oluşumu)
2. Ayrışma (Analiz) Tepkimeleri
Bir bileşiğin, kendisini oluşturan daha basit bileşenlere veya elementlere ayrıldığı tepkimelerdir.
Genel denklem: AB → A + B
Örnek: 2H₂O → 2H₂ + O₂ (Suyun elektrolizi)
3. Yer Değiştirme (Tek Yer Değiştirme) Tepkimeleri
Bir elementin, bileşik içindeki başka bir elementi yerinden çıkardığı reaksiyonlardır.
Genel denklem: A + BC → AC + B
Örnek: Zn + CuSO₄ → ZnSO₄ + Cu (Çinko, bakır sülfat çözeltisiyle reaksiyona girerek bakır açığa çıkarır)
4. Çift Yer Değiştirme Tepkimeleri
İki bileşiğin iyonlarının karşılıklı olarak yer değiştirdiği reaksiyonlardır. Genellikle çökelek oluşumu, gaz çıkışı veya nötrleşme tepkimeleri şeklinde gerçekleşir.
Genel denklem: AB + CD → AD + CB
Örnek: AgNO₃ + NaCl → AgCl (çökelti) + NaNO₃
5. Yanma Tepkimeleri
Bir maddenin oksijen ile reaksiyona girerek ısı ve ışık açığa çıkardığı tepkimelerdir. Genellikle hidrokarbonlar ve diğer organik bileşiklerin oksijenle tepkimesi sonucu su ve karbondioksit oluşur.
Genel denklem: CₓHᵧ + O₂ → CO₂ + H₂O + Enerji
Örnek: CH₄ + 2O₂ → CO₂ + 2H₂O + Isı (Metan gazının yanması)
6. Asit-Baz (Nötrleşme) Tepkimeleri
Asitler ve bazlar arasındaki reaksiyonlarda genellikle tuz ve su oluşur.
Genel denklem: Asit + Baz → Tuz + Su
Örnek: HCl + NaOH → NaCl + H₂O
7. Çökme (Çökelme) Tepkimeleri
Çözeltide bulunan iyonların birleşerek çözünmeyen bir katı madde (çökelti) oluşturduğu reaksiyonlardır.
Örnek: BaCl₂ + Na₂SO₄ → BaSO₄ (çökelti) + 2NaCl
8. Oksitlenme-İndirgenme (Redoks) Tepkimeleri
Elektron alışverişine dayanan tepkimelerdir. Oksitlenme, bir elementin elektron kaybetmesi; indirgenme ise elektron kazanmasıdır.
Örnek: Fe + O₂ → Fe₂O₃ (Demirin paslanması)
Kimyasal tepkimeler, doğadaki ve endüstrideki birçok sürecin temelini oluşturur. Bu farklı tepkime türlerinin anlaşılması, kimya mühendisliği, çevre bilimi ve biyokimya gibi birçok alanda önemli uygulamalar sunar.
Kimyasal Tepkime Süreçlerinde Paslanmaz Reaktör Teknolojisinin Gücünü Keşfedin!
Yazar:
Endüstriyel Tasarım Mühendisi